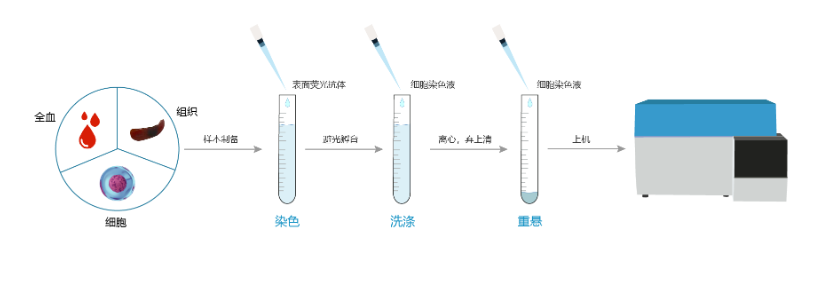
一、样本准备
1. 收集细胞,200目筛网过滤,收集滤液,300 g离心5 min,弃上清
2. 向细胞中加入适量细胞染色buffer(或含1%BSA的PBS),用移液枪轻轻吹打细胞重悬
二、细胞计数
用血球计数板或其他仪器对悬液进行计数后,调整细胞浓度约为1 × 107/mL
三、设置实验分组
实验分组 | 作用 |
阴性/空白对照 | 调节仪器电压 |
单染/单阳对照 | 调节补偿 |
同型对照 | 消除背景染色 |
FMO对照 | 确定设门的准确性 |
生物学对照 | 实验结果对比 |
实验组 | 实验结果 |
四、封闭Fc受体
封闭Fc受体能减少染色过程中的非特异性染色。
小鼠中,纯化的CD16/CD32单抗能和FcγRⅢ/Ⅱ结合,封闭非特异性染色,使阴性细胞的背景荧光降至未标记细胞的水平。加入0.5-1μg纯的抗小鼠CD16/32单克隆抗体,室温孵育10分钟。
对于人和大鼠,可直接使用过量的,与荧光抗体相同来源和亚型的纯化Ig或者与目标种属相同来源的血清进行阻断,或者用商业化的Fc受体阻断剂。
五、细胞染色
1. 按照说明书的推荐用量加入荧光标记抗体,混匀后置于4℃,避光孵育30分钟。
2. 加入细胞染色buffer (或含1%BSA的PBS)重悬细胞,300g离心细胞悬液5分钟,弃掉上清。
3. 加入200μL细胞染色buffer(或含1%BSA的PBS)重悬细胞,用流式细胞仪进行检测和分析。